INTRODUÇÃO: O CATALISADOR DE FCC
História do processo de FCC
O processo de craqueamento catalítico Fluido (FCC) é sem dúvida o coração da refinaria e pode ser considerado um dos mais importantes processos da Indústria química. Este processo converte resíduos atmosféricos pesados e destilados de vácuo em frações mais valorizadas tais como gasolina, diesel, querosene e GlP.
No início do século 19, as lâmpadas para iluminação interna muitas vezes utilizavam óleo de baleia como combustível. Iluminantes à base de petróleo tais como lampiões começaram a substituir o óleo de baleia em torno de 1850, dando origem a uma indústria emergente que produzia querosene a partir do refino de óleo cru. Por volta do fim do século a indústria automotiva, em crescimento, propiciou um uso alternativo a frações leves de petróleo, principalmente gasolina. logo o fornecimento de gasolina de destilação direta como combustível para motores automotivos se tornou insuficiente. Por esta razão, a indústria do petróleo começou a buscar processos alternativos objetivando aumentar a produção de frações mais leves. Este fato foi a força motriz para o primeiro processo de craqueamento, o craqueamento Térmico1. O processo de craquea mento térmico (também conhecido como “processo de craqueamento Shukhov”) foi inventado pelo engenheiro russo Vladimir Shukhov e patenteado em 1891 no Império Russo, patente n° 12926, em 27 de novembro de 1891. Mais tarde, este processo foi modificado pelo engenheiro americano William Merriam Burton e patenteado como patente norteamericana U.S. 1.049.667 em 8 de junho de 1908.
À medida que motores mais novos e mais potentes foram sendo desenvolvidos, foi exigida gasolina de mais alta octanagem. Além disso, motores de avião necessitavam de combustível com índices de octanas próximos de 100. Tais características não poderiam ser obtidas através do processo tradicional de craqueamento térmico. Portanto, a descoberta de um processo de craqueamento mais eficiente, pelo engenheiro francês Eugene houdry nos anos 1920, permitiu que as refinarias produzissem gasolina de octanagem mais elevada, permitindo igualmente um aumento no fornecimento da mesma. Este processo foi denominado craqueamento catalítico (conhecido como “craqueamento catalítico de leito fixo de houdry”), já que reações de craqueamento eram promovidas por um catalisador sólido3. O processo compreendia vários reatores separados atuando como um processo cíclico, ou melhor, enquanto em alguns reatores ocorria craqueamento, em outros o catalisador sofria regeneração por queima de coque com ar. O conceito de craqueamento térmico foi aperfeiçoado adicionalmente pelo craqueamento catalítico Thermofor da Mobil (Tcc), no qual um leito móvel de catalisador com um macrocatalisador (esferas com diâmetro de 1,5-2mm) era usado. O sistema de leito móvel aumentou o rendimento de gasolina em 15% em relação ao sistema de leito fixo.
O conhecimento sobre leitos fluidizados junto com a preparação de catalisador em partículas finas foi a base para o desenvolvimento do processo de craqueamento catalítico Fluido (FCC). O uso de partículas pequenas oferecia vantagens em termos de transferência de calor e difusão de massa em relação às grandes pelotas de catalisador usadas tanto em leito fixo como em Tcc. A primeira unidade de Fcc iniciou em Maio de 1942, na refinaria da Standard Oil de new jersey em Baton Rouge, louisiana. A enorme demanda por combustíveis para motor e aviação devida à 2ª Guerra Mundial ajudou a estabelecer este processo. na verdade, entre 1942 e 1945, 34 novas unidades foram postas em andamento.
O aperfeiçoamento da tecnologia de Fcc foi efetuado através de vários tipos de reatores. De fato, o primeiro foi um reator de fluxo ascendente Modelo I FCC, seguido pelo reator de fluxo descendente Modelo II FCC. Foram igualmente desenvolvidos o projeto de reator empilhado, Esse modelo 4 e o riser reto. Por fim, o projeto side-by-side com riser reto, melhor para unidades grandes, foi comercializado em 1950.
O catalisador de FCC
O primeiro uso comercial de craqueamento catalítico ocorreu em 1915 quando A. M. McAfee desenvolveu um processo em batelada usando cloreto de alumínio (que era um catalisador tradicional de Friedel crafts conhecido desde 1877) para promover o craqueamento de petróleos pesados. no entanto, o custo proibitivo do catalisador impediu o uso generalizado do processo de McAfee na época.
Os catalisadores para craqueamento são historicamente subdivididos nos seguintes três grupos principais:
- catalisadores naturais – argilas, como bentonita ou montmorilonita, eram submetidas a tratamento ácido para remover na e Mg e aumentar sua acidez;
- catalisadores amorfos – estes eram géis de sílica e alumina, resultantes da reação de na2SiO3 e Al2(SO4)3. havia dois tipos desses catalisadores, baixa alumina (10 a 15% de Al2O3) e alta alumina (20 a 30% de Al2O3);
- catalisadores cristalinos – Microesferas (40150 µm), tendo como componente principal uma zeólita cristalina.
Na realidade, houdry foi o primeiro a usar as bentonitas tratadas com ácido como catalisadores de craqueamento, já em 1936. nos anos 1940, catalisadores de sílica alumina foram sintetizados e aperfeiçoaram grandemente o desempenho de catalisadores à base de argila. Os primeiros catalisadores sintéticos amorfos de sílica-alumina continham cerca de 13% em peso de Al2O3 (baixa alumina), no entanto, em 1955, o teor de Al2O3 tinha sido elevado para cerca de 25%.
Em 1962 ocorreu a inovação catalítica mais importante do processo de Fcc, quando um componente, conhecido como Zeólita-y, foi adicionado ao catalisador ativo de alumina. Foi verificado que através da adição de pequenas proporções de zeólita na matriz do catalisador antigo de sílica-alumina, havia sido produzido um novo catalisador. Esse catalisador tinha um desempenho excelente, muito melhor do que qualquer catalisador anterior. O catalisador zeolítico melhorou muito o rendimento em gasolina (Tabela 1). Os primeiros catalisadores zeolíticos comerciais foram introduzidos em 1964, e os catalisadores zeolíticos continuam a ser usados atualmente.
No entanto, deve-se ter em mente que a gasolina produzida via os catalisadores zeolíticos originais tinha um número de Octanas (ROn) mais baixo. Isto foi correlacionado posteriormente com o fato de que zeólitas, tendo uma densidade muito elevada em sítios ácidos, estavam aumentando a Reação de Transferência de hidrogênio (HTR) como descrito abaixo.

Essa reação é prejudicial à qualidade da gasolina quando se trata de ROn. Por esta razão as zeólitas sofreram vários tipos de modificações visando reduzir transferência de hidrogênio, aumentando assim o ROn da gasolina.
Os catalisadores de FCC atuais
Embora um elevado número de formulações possa ser encontrado atualmente quando se trata de catalisadores de Fcc, para qualquer formulação os componentes do catalisador podem ser classificados como segue:
[a] COMPONENTE ATIVO – responsável pela maior parte da atividade do catalisador, constituído em geral por faujasitas (ou zeólitas-Y). Atualmente, outra zeólita tem sido usada (ZSM-5).
[b] MATRIZES – elas promovem conversão de fundos, aumentando a atividade global do catalisador. Elas precisam ter certa tolerância a Ni e V, a compostos nitrogenados e, quando possível promover efeitos DESOX. Elas também devem ter propriedades ligantes.
- Matriz ativa – normalmente, a matriz ativa é uma alumina, que é ácida, embora menos ácida do que a zeólita, e por outro lado, aluminas têm poros muito maiores do que a zeólita, portanto elas promovem o pré-craqueamento de moléculas mais pesadas;
- Matriz inerte – normalmente, a matriz inerte é uma argila, como caulim, sendo usada para conferir propriedades físicas;
- Matriz sintética – a matriz sintética é na realidade um ligante que mantém todos os outros componentes ligados no catalisador final.
[c] INGREDIENTES FUNCIONAIS – ingredientes adicionados ao catalisador para desempenhar uma função específica (isto é, traps para capturar compostos de Vanádio).
Os catalisadores de Fcc estão em constante modificação, novos catalisadores comerciais sendo entregues ao mercado a cada seis meses ou menos. na verdade, novas formulações estão sendo desenvolvidas constantemente, objetivando:
- Desfavorecer a formação de coque;
- Promover a conversão de fundos;
- Apresentar alta resistência a metais (V, Ni e Fe);
- Exibir desempenho excelente em termos de octanas, já que compostos contendo chumbo não podem mais ser usados.
A preparação de catalisadores de FCC
Como mencionado anteriormente, os catalisadores de Fcc são espécies multicomponentes, cuja preparação não é trivial. O tipo de componente usado, os ingredientes usados na preparação dos mesmos, a ordem de adição destes ingredientes e como eles respondem à calcinação sob vapor determinarão as características finais do catalisador. Embora diferentes tecnologias possam ter diferentes etapas na preparação do catalisador, as etapas convencionais podem ser didaticamente divididas em:
a) Preparação da Zeólita;
b) Modificações da Zeólita;
c) Formação da Partícula (por secagem por atomização ou spray drying);
d) Troca Iônica;
e) lavagem;
f) Secagem;
g) calcinação.
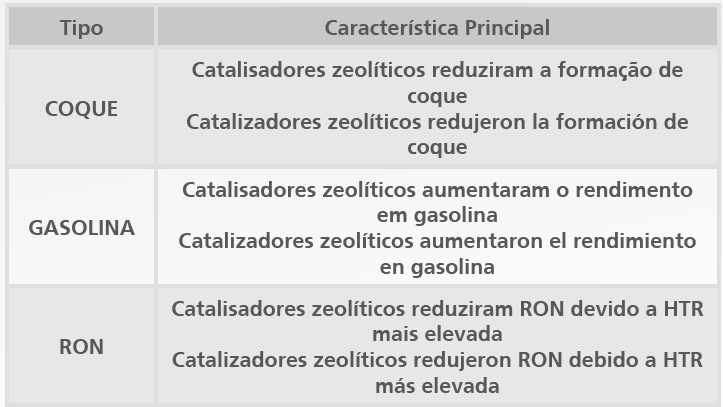
Na verdade, a partícula de catalisador de Fcc é muito similar a uma partícula de concreto. O concreto é um material de construção compósito composto primariamente de brita, cimento e areia, cujos tamanhos relativos são 15, 250 e 5000. Em relação à partícula de catalisador, tem-se um ligante, alumina e zeólita/argila, que têm aproximadamente os mesmos tamanhos relativos (Figura 1), formando uma partícula de dureza considerável.
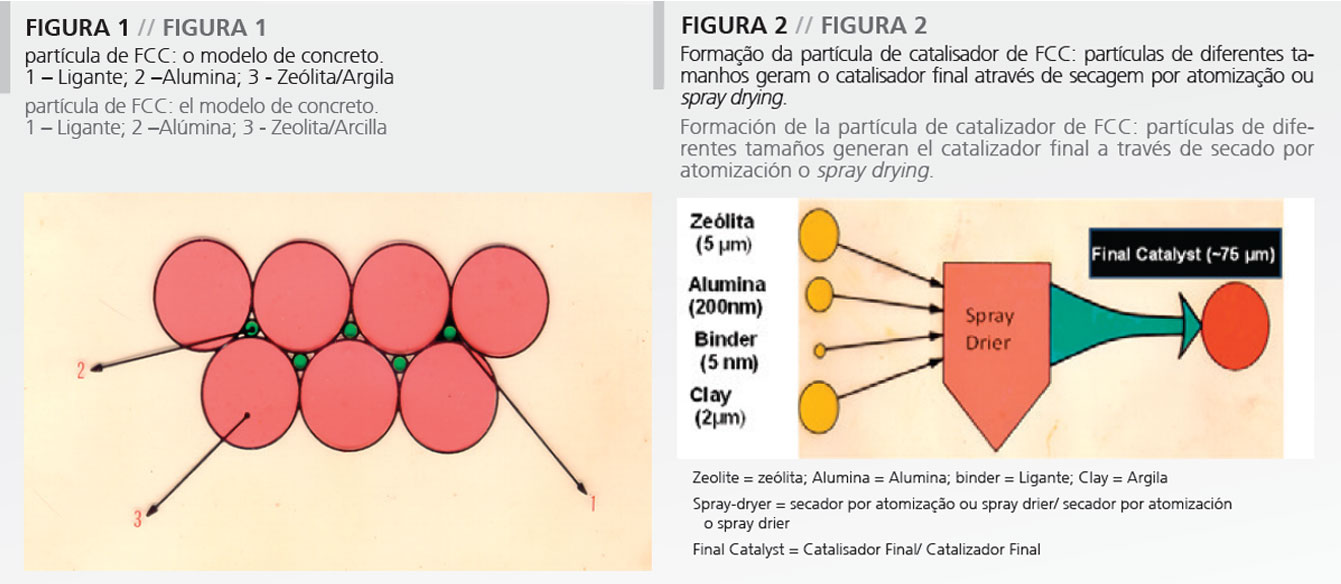
Como demonstrado na Figura 2, os diferentes componentes, isto é, a alumina, a zeólita e a argila são basicamente pós que têm diferentes tamanhos médios de partícula. Eles são em geral colocados em suspensão em um frasco, junto com o ligante, em geral produzido in situ. Após efetuar a suspensão de todos os componentes, é preciso formar a partícula de catalisador. A formação da partícula requer o uso de uma tecnologia qualquer de formação de partícula. Normalmente, é escolhida a secagem por atomização ou spray drying já que ela pode prover o produtor com uma distribuição relativamente estreita de tamanho de partícula e boa resistência ao atrito, que é uma das maiores preocupações no desempenho do catalisador de FCC (Figura 2). Adicionalmente, muitas tecnologias exigem uma etapa final de calcinação a fim de aumentar a dureza do catalisador. No entanto, a calcinação deve ser efetuada com cuidado, já que o componente zeólita é muito sensível à calcinação por vapor.
O componente zeólita
Há várias razões pelas quais as zeólitas se tornaram o catalisador preferido para muitas reações de importância industrial. no processo de craqueamento, as seguintes características merecem atenção especial:
a) estabilidade térmica: Por certo, uma das razões mais importantes para basear a seleção de zeólitas como catalisador para reações a alta temperatura é sua boa estabilidade térmica. A maior parte das zeólitas não é afetada por temperaturas de até 650°c. Para zeólitas que apresentam altas razões sílica-alumina, o colapso estrutural se torna significativo somente a temperaturas tão elevadas quanto 1000°c. Além disso, a introdução de átomos Terras Raras na zeólita também aumenta a estabilidade térmica. Portanto, essas zeólitas são adequadas para processos de craqueamento catalítico fluido, onde prevalecem altas temperaturas e outras condições operacionais agressivas.
b) acidez: Zeólitas exibem acidez muito mais alta do que os primeiros catalisadores amorfos de sílicaalumina. Além disso, as zeólitas têm sítios ácidos tanto de Brönsted como de lewis. A densidade desses sítios ácidos está correlacionada à razão sílica-alumina (SAR) na estrutura zeolítica. Essa densidade aumenta com o teor de alumínio. no entanto, à medida que a SAR aumenta e a densidade de sítios diminui, a força de sítios isolados aumenta, atingindo um máximo. Em geral, os seguintes parâmetros afetam a acidez de uma zeólita:
1. A natureza e tipo dos sítios ácidos
2. A densidade ou concentração dos sítios ácidos
3. A distribuição de força dos sítios ácidos
4. A localização dos sítios ácidos no interior da estrutura zeolítica
5. A distribuição geométrica dos sítios ácidos sobre os cristais de zeólita.
Um parâmetro importante que governa a acidez por unidade de célula na estrutura zeolítica é o Tamanho de célula Unitária (UcS), representado pelo símbolo A0. O valor de A0 está relacionado à SAR da zeólita.
c) Seletividade de forma 10,11,12: As dimensões dos poros no interior da estrutura zeolítica são muitas vezes similares aos tamanhos das moléculas que participam nas reações que elas catalisam, gerando uma forte influência na seletividade destas reações. Os principais tipos de seletividade são os seguintes:
- Seletividade do reagente ocorre quando somente parte das moléculas reagentes são suficientemente pequenas para difundir através dos poros do catalisador.
- Seletividade do produto ocorre quando parte dos produtos formados no interior dos poros são excessivamente volumosos para difundir sob forma de produtos observados. Eles são convertidos ou em moléculas menos volumosas ou eventualmente desativam o catalisador pelo bloqueio de poros.
- Seletividade restrita do estado de transição ocorre quando certas reações são impedidas porque o estado de transição correspondente exigiria mais espaço do que aquele disponível nas cavidades. nem o reagente nem as moléculas potenciais de produto são impedidos de difundir através dos poros. As reações que necessitam estados de transição mais baixos ocorrem sem impedimento.
- Controle de tráfego molecular pode ocorrer em zeólitas com mais de um tipo de sistema de poro. Aqui as moléculas de reagente podem entrar preferencialmente no catalisador através de um dos sistemas de poro enquanto os produtos difundem através do outro sistema de poro.
d) efeitos de Concentração: Efeitos de concentração estão relacionados aos conceitos de hidrofilicidade ou hidrofilicidade das zeólitas, afetando a seletividade da reação. Essas propriedades podem ter um ajuste fino quando as zeólitas estão sendo sintetizadas, produzindo zeólitas específicas para certa finalidade.
Como mencionado anteriormente, o componente zeolítico é o componente mais importante no catalisador de Fcc, sendo capaz de prover o catalisador tanto com a acidez quanto com a seletividade convenientes. Em catalisadores de Fcc, a zeólita empregada é faujasita, ou antes, a estrutura FAU. A razão Si/Al da zeólita-y preparada é uma característica importante desse material já que quanto mais alta a razão Si/Al, mais estável é a zeólita em relação a desaluminização ácida e hidrotérmica.
A zeólita é sintetizada na forma sódica, que é uma forma não-ativa, já que os sítios ácidos (sítios ácidos de Brönsted) responsáveis pela formação de carbocátions e portanto reações de craqueamento não estão presentes. Assim, a zeólita nay deve sofrer troca iônica com amônio (ou íons Terras Raras) para preparar a forma amônio/TR da zeólita que dará origem à forma ácida hy por calcinação.
Zeólitas REY
A introdução de ELEMENTOS TERRAS RARAS no componente zeolítico, via troca iônica, seguida de uma etapa de calcinação, é uma das mais importantes modificações efetuadas no processo de preparação de catalisadores de FCC, já que ela aumenta tanto a estabilidade da zeólita quanto a atividade geral do catalisador. Além disso, a calcinação promove a desaluminização da estrutura, mudando as características de acidez e de textura da zeólita.
Zeólitas com teores elevados de La e Ce, que foram calcinadas em presença de vapor ou não, foram estudadas usando o refinamento de estrutura de Rietveld. Como representado na Figura 3, vários sítios cristalográficos podem ser encontrados na estrutura da zeólita-Y.

Os resultados da Tabela 2 mostram que:
- Após troca iônica, TR são localizadas nos sítios 4 e 5 na supergaiola;
- No entanto, após calcinação, ocorre migração para a gaiola sodalita e prisma hexagonal;
- Essa migração ocorre não importa o tipo de átomo TR (La ou Ce).

Além disso, 27Al-MAS/NMR confirma que por calcinação está ocorrendo desaluminização; no entanto, não é observado o colapso da estrutura. De modo interessante, como relatado anteriormente, a temperatura de colapso da estrutura aumenta com a introdução de TR, não importando o tipo de cátion TR introduzido (Figura 4).

Outra questão importante é relativa à acidez de zeólitas-Y contendo TR. Estudos 15 com zeólitas com o mesmo teor de diferentes cátions (La, Nd, Sm, Gd, Dy) verificaram que o raio iônico do cátion representa um papel importante na formação de sítios ácidos de Brönsted.
O espectro de IR (região do OH) mostra claramente que a introdução de TR gera uma banda entre 3490-3530 cm-1 (OH interagindo com TR). Essa banda sofre um deslocamento para números de onda mais altos à medida que o raio iônico aumenta.
Uma banda muito intensa entre 3496/3530 cm-1 é atribuída à existência de grupos OH associados a cátions TR. Um deslocamento nesta banda após adsorção de PY (ou lutidina) é observado, o qual foi atribuído a um aumento na força ácida do OH associado a cátions de terras raras. De fato, é possível observar uma correlação linear entre o raio iônico do cátion de terra rara e o número de onda da banda.
Algumas conclusões muito interessantes podem ser tiradas desta série de experimentos e caracterização. De fato, por calcinação, as TR realmente migram para sítios mais internos.Uma vez posicionados no interior da gaiola sodalita e o prisma hexagonal, são formados grupos TR-O-TR. Esses grupos têm capacidade para estabilizar a estrutura zeolítica através da geração de pontes com os átomos de oxigênio da mesma. Além disso, o grau de estabilização depende do grau de troca de TR (Figura 5).
Em relação à acidez, cátions TR(H2O)n sofrem hidrólise por calcinação, gerando sítios ácidos de Brönsted. Essa reação de hidrólise permite que seja explicada a concentração de sítios ácidos mais elevada em zeólitas TRYC (TR-Y Calcinadas) e sua atividade mais alta. Os sítios de Brönsted parecem ser uma função do tipo de cátions TR introduzidos na zeólita.
Uma outra questão importante diz respeito à atividade. Artigos publicados anteriormente também mostraram, usando o craqueamento de n-heptano como molécula sonda:
- Atividade depende do grau de troca iônica;
- Um máximo é atingido para 40% de troca com Na;
- Aparentemente as seguintes reações estão ocorrendo:

Estas reações explicam porque uma atividade máxima é atingida dependendo do grau de troca. No entanto, essa atividade máxima depende tanto do tipo de cátion TR como do tipo de reação modelo. Em termos de craqueamento, a presença de TR na zeólita afeta a capacidade de transferência de hidrogênio. A reação de Transferência de Hidrogênio (HT), no processo de FCC, é muito importante já que:
- Ela compete com outras reações importantes como o próprio craqueamento, isomerização e alquilação;
- Ela transforma olefinas em parafinas, reduzindo o RON da gasolina;
- Ela é portanto determinante para a seletividade do processo.
A presença de TR aumenta a acidez de Brönsted, portanto TR afetam tanto a atividade como a seletividade. Quanto maior o raio iônico do átomo de TR, mais alta a acidez gerada na zeólita. Já que HT aumenta com a acidez aumentada da zeólita, quanto mais alto o raio atômico do átomo de TR, mais elevada será a HT. Em geral, TR favorece HT, reduzindo RON pela redução da concentração de olefinas na gasolina. No entanto, já que TR também afetam a estabilidade da zeólita, às vezes a avaliação pode ser equivocada. Igualmente, é preciso ter em mente que os resultados industriais mostram que TR parecem ter pouca influência sobre o MON da gasolina. Finalmente, vale a pena mencionar que Terras Raras também têm um papel importante na prevenção da desativação de metais já que elas constituem uma armadilha muito eficiente para Vanádio.
Conclusões
Elementos Terras Raras constituem de fato um componente muito importante dos catalisadores de FCC. No entanto, Terras Raras estão enfrentando um problema terrível de aumento de preço e redução de disponibilidade. Assim, tem sido pesquisada a remoção destes ingredientes da composição de catalisador de FCC. No entanto, a remoção total de elementos Terras Raras do componente zeolítico de um catalisador de FCC resultaria em um efeito detrimental considerável na maior parte das operações de FCC devido à atividade mais baixa e volume piorado de rendimento de produção, para não falar no problema de maior desativação por Vanádio.
Por esta razão, outros elementos como Ca e Cr foram ensaiados, sem resultados encorajadores. Recentemente, produtores (Catalysts Technologies) anunciaram a comercialização bem sucedida de Catalisador para FCC com Zero/Baixo Teor de Terras Raras. Deve-se ter em mente que algumas características especiais relativas a este catalisador devem estar presentes, tais como:
- Proporções muito altas de matrix seletiva;
- Alta acessibilidade;
- Altos níveis de zeólita para atividade aumentada;
- Alta razão sílica-alumina (SAR), que resulta em estabilidade superior da zeólita;
- Cargas de baixo teor de Vanádio.
-

- de
-
































O que você achou da publicação?